
Un estudio publicado en Acta Crystallographica describe la caracterización estructural y funcional de la lisina del fago JG004 de Pseudomonas aeruginosa, denominada Pae87, como agente antibacteriano. El trabajo ha sido coordinado por Pedro García (Centro de Investigaciones Biológicas Margarita Salas, CIB-CSIC y CIBERES) y Mark van Raaij (Centro Nacional de Biotecnología, CNB-CSIC) y forma parte de la tesis doctoral presentada por Roberto Vázquez, investigador del CIBERES -perteneciente al grupo de José Yuste en el ISCIII-.
La resistencia a los antibióticos se está convirtiendo en una de las amenazas más graves para la salud pública en todo el mundo, ya que la proporción de cepas bacterianas multirresistentes está creciendo progresivamente, estimándose ya más de un millón de muertes anuales en todo el mundo por esta causa. Por ello, la búsqueda de tratamientos alternativos a los antibióticos estándar para combatir estas "superbacterias" patógenas es cada vez más urgente. Las lisinas de los bacteriófagos (fagos) son enzimas que degradan el peptidoglicano bacteriano y son una fuente prometedora de nuevos antimicrobianos, activos frente a bacterias resistentes a antibióticos. La adición exógena de estas lisinas purificadas ("lisis desde fuera") provoca la rápida degradación del sustrato (el peptidoglicano) y, por tanto, la lisis y muerte de las bacterias susceptibles, incluidas las cepas multirresistentes. En su uso antibacteriano, las lisinas se conocen también como “enzibióticos”. La ingeniería de estas enzimas es una estrategia tecnológica con potencial revolucionario para introducir un enfoque más preciso o personalizado en la forma de aplicar la terapia antimicrobiana. Estos esfuerzos de ingeniería de proteínas requieren, sin embargo, una mejor comprensión de la estructura y la función de las lisinas.
En este artículo se describen estudios bioquímicos, llevados a cabo principalmente por Roberto Vázquez, y estructurales, por parte de Mateo Seoane, de la lisina Pae87. Se ha concluido que esta proteína posee una actividad enzimática muramidasa, capaz de degradar las cadenas glicánicas del peptidoglicano de la pared celular bacteriana, y se han caracterizado los aminoácidos específicos involucrados en dicha actividad catalítica. Sin embargo, la actividad bactericida de Pae87 añadida exógenamente no se asoció a la actividad catalítica, sino a una actividad no enzimática sobre las membranas de las bacterias Gram-negativas, que con toda probabilidad reside en un péptido catiónico y anfipático de la región C-terminal denominado P87. Se ha demostrado, igualmente, que el péptido P87 presenta por sí solo una potente actividad antibacteriana.
La estructura cristalina de alta resolución de Pae87 en complejo con un fragmento de peptidoglicano mostró una región separada de unión a sustrato dentro del propio dominio catalítico. Esta región de unión al sustrato está conservada entre las lisinas relacionadas que carecen de un dominio adicional de unión a la pared celular, pero no entre las que contienen dicho módulo, por lo que puede cumplir una función evolutiva compensatoria.
En definitiva, este estudio analiza varios de los elementos funcionales presentes en la estructura de la lisina Pae87, y pone de relieve que el resultado funcional de este tipo de proteínas emerge de una serie de mecanismos complejos que pueden incluir la colaboración entre diversas actividades dentro de la proteína, sin que la actividad catalítica sea necesariamente la más evidente o la más relevante.
"Estos resultados abren el camino para futuros esfuerzos de diseño y obtención de antimicrobianos basados en lisinas fágicas, no solo mediante la modificación de las enzimas completas, sino también derivando pequeños péptidos antimicrobianos de su estructura" explican los investigadores.
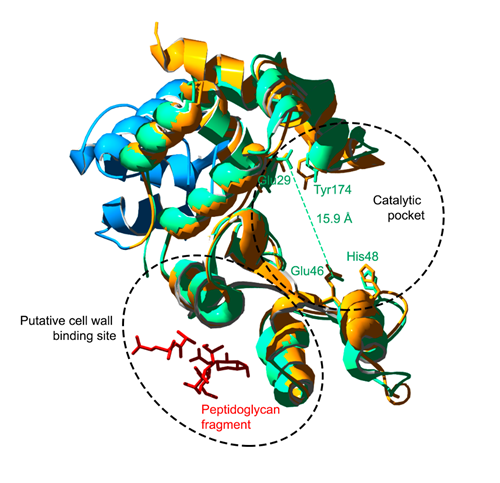
Modelo estructural de Pae87. La estructura tridimensional de Pae87 (en verde) está superimpuesta sobre la de AP3gp15, lisina codificada por un fago de Burkholderia (en amarillo el dominio catalítico, en azul el dominio de unión a sustrato). Se muestra el posible sitio catalítico y el de unión a sustrato, así como los residuos conservados del bolsillo catalítico.
Referencia del artículo:
Vázquez R, Seoane-Blanco M, Rivero-Buceta V, Ruiz S, van Raaij MJ, and García P*. 2022. Monomodular Pseudomonas aeruginosa phage JG004 lysozyme (Pae87) contains a bacterial surface-active antimicrobial peptide-like region and a possible substrate-binding subdomain. Acta Crystallographica section D. http://doi.org/10.1107/S2059798322000936. *, autor de correspondencia.